单克隆抗体、抗体-药物偶联物、双特异性抗体、检查点抑制剂等基于抗体的疗法,已经在治疗各种癌症方面展现了它们的临床优势。尽管大多数治疗性抗体对其靶标具有高亲和力,然而正常组织中存在的相同靶标显著地限制着抗体击中靶标的能力,同时也会引起不可接受的“靶标”毒性效应。此外,抗体在某些组织(例如脑或骨骼)的低穿透力也限制了该治疗手段在这些组织中的治疗功效。因此,增强抗体的抗原和组织特异性将会极大地改善抗体疗法在癌症临床中的治疗效果。
2021年6月23日,来自美国德克萨斯州莱斯大学的Han XIAO教授和贝勒医学院的Xiang ZHANG教授团队在Science Advances发表了题为 Harnessing the power of antibodies to fight bone metastasis的研究成果。研究使用新型的骨靶向 (BonTarg) 技术来生产特异性骨靶向抗体并用于乳腺癌的骨转移模型。

作者使用pClick偶联技术将骨靶向基团双膦酸盐位点特异性地(site-specifically)偶联到治疗性抗体上(图1A)。相对于其它组织,双膦酸盐修饰的抗体高度富集于骨转移灶。在异种移植小鼠模型中,该抗体对乳腺癌引起的骨转移和多器官继发性转移有显著性的抑制作用。因此,该技术在将治疗性抗体特异性递送至骨病变灶,治疗骨转移性癌症和其他骨疾病方面展现出良好的应用前景。
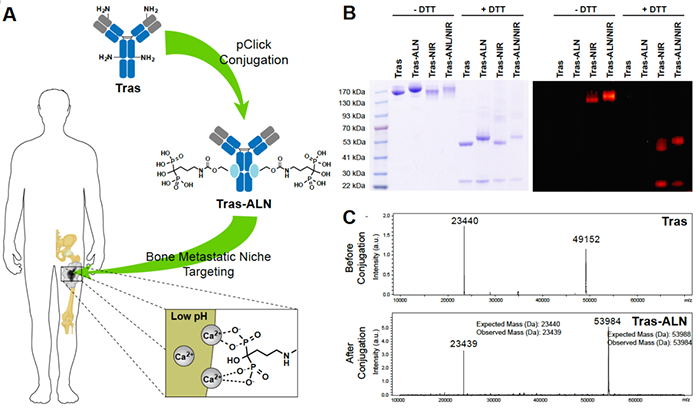
为了制备 Tras-ALN 偶联物,作者首先使用 pClick 生成含有叠氮化物的 Tras,然后与双环 [6.1.0] 壬炔 (BCN) 化的 ALN 反应(图1A),得到的 Tras-ALN。通过SDS-PAGE 显示偶联效率超过 95%,未发现未结合的重链或降解产物(图1B)。ESI-MS 分析还显示超过 95% 的重链与 ALN 分子结合(图1C)。同时,作者也测试了ALN偶联对抗原结合力和特异性的影响。结果显示,Tras 和 Tras-ALN 对 HER2 表达细胞系 BT474、SK-BR-3 和 MDA-MB-361 具有强结合亲和力,但对 HER2 阴性细胞系 MDA-MB-468 则没有,表明ALN偶联未改变抗体特异性。为了确定骨靶向 Tras 是否可以用作乳腺癌骨转移的新治疗方法,作者基于髂内动脉 (IIA) 注射的方法构建了两个异种移植模型。如图所示,Tras-ALN 偶联产物显著抑制了骨转移癌症发展(图2A和2B),并限制了骨转移癌向其他器官的继发性转移。此外,在所有接受治疗的小鼠中都没有观察到体重减轻的迹象,这表明不存在明显骨靶向抗体相关的毒性(图 2E)。同时,与未修饰的抗体相比,Tras-ALN治疗组的对各种器官 (如,心,肝,脾,肺,肾,脑) 的继发性转移也有显著的降低作用。

总结而言,本文使用新的 BonTarg 技术,作者通过用骨靶向基团对抗体进行特异性位点的修饰,制备了骨靶向抗体。由此产生的骨靶向抗体在治疗乳腺癌骨转移和预防骨转移癌的继发性转移方面表现出较好的体内治疗效果。这种将生物药物精确输送到骨病灶位置为治疗骨及其相关疾病提供了一种新的的治疗手段。
该论文第一作者为田泽儒和吴岭博士,通讯作者为Han XIAO和Xiang ZHANG教授。
原文链接:
https://advances.sciencemag.org/content/7/26/eabf2051













